大 魔神 佐々木 競馬 予想緩衝液:中和によって緩衝液や塩の水溶液のpHを計算する手順 . なお、緩衝液は中和反応によって作ることもできます。ここまで、酢酸と酢酸ナトリウムを混合する場面で解説してきました。そこで酢酸と酢酸ナトリウムを加えるのではなく、中和反応によって緩衝液を作りましょう。 例えば酢酸に水酸化ナトリウムを加える場合、以下の反応が起こります。 1. CH3COOH + NaOH → … 詳細. 緩衝液(仕組み・共通イオン効果・濃度を使ったpH …. 酢酸と酢酸ナトリウムが0.12molずつ含まれた1.0Lの混合溶液がある。(1)この混合溶液のpHを求めよ。ただし、酢酸のpK a は4.7とする。(2)この混合溶 …. 酢酸、酢酸ナトリウム混合溶液のpH計算方法 - ジグ …. 酢酸、酢酸ナトリウム混合溶液のpHを求めるためには、酢酸と酢酸ナトリウムの平衡反応を理解しておく必要があります。酢酸、酢酸ナトリウムのpH計算方法は以下の記事で丁寧に解説していますので、理解してから本 …. 酢酸 と 水 酸化 ナトリウム ph酢酸水溶液と水酸化ナトリウム水溶液の混合物 pH - 教えて!goo. 酢酸と水酸化ナトリウムは反応するわけだから、最初にその反応を考え. その反応の結果生じた物質と残った酢酸を考えれば溶液 …. 緩衝(かんしょう)溶液とは?緩衝作用の原理と緩衝 …. 扇 の 的 原文
歯石 を 取る酢酸の電離定数と酢酸と酢酸ナトリウムのモル濃度の比によってpHが決まる、 ということができます。 この緩衝溶液を水で薄めても酢酸イオンと酢酸のモ …. 【改訂版は概要欄へ】中和点のpH計算 酢酸と水酸化ナトリウム . 酢酸 と 水 酸化 ナトリウム ph【改訂版は概要欄へ】中和点のpH計算 酢酸と水酸化ナトリウム 中和点のpHの求め方 塩の加水分解度と加水分解定数の覚え方 中和 …. 【高校化学】緩衝液の原理を例を挙げて、簡単に解説!なぜpH . 酢酸ナトリウム由来の酢酸イオンとナトリウムイオン、酢酸分子のみとなります。 ☆ 緩衝液のpHが一定に保たれる理由 ・ 水素 …. 中和滴定曲線 - kitasato-u.ac.jp. ここでは例として酢酸と水酸化ナトリウムの滴定についてpHを計算します。 滴定前のpH. 当量点前のpH. 当量点のpH. 当量点後のpH. 酢酸 と 水 酸化 ナトリウム ph弱酸と強塩基の中和滴定. 緩衝液と緩衝作用 | ねこでもわかる化学. これらの水溶液は水で十分に希釈すれば、pHは低下するのである。 しかし、pH = 4.7の酢酸ー酢酸ナトリウムの緩衝溶液は、[CH 3 COOH]/[CH 3 COO – ]の比が変わらないため、10倍に希釈してもpHはほとんど変化し …. pH 計算の実際(緩衝液) - 酸・塩基 - Chemist Eyes. 酢酸 と 水 酸化 ナトリウム ph酢酸イオンという物質だけを追加するわけにはいかないので,具体的には酢酸ナトリウムのような完全電離する酢酸塩を加えることになりますが, …. 酢酸を水酸化ナトリウムで滴定したときのpHの計算 - 0.1mol/l酢 …. ベストアンサー:酢酸と水酸化ナトリウム水溶液がほぼ完全中和したとき、pHは、塩基性だからですよ。 CH3COOH CH3COO- + …. 酢酸ナトリウムのpHを計算できますか? | ジグザグ科学.com. 水に溶けると、酢酸イオンCH 3 COO – とナトリウムイオンNa + に完全に解離します。 生成した酢酸イオンCH 3 COO – は水H 2 …. pHと中和滴定:実験操作・指示薬の種類や二段階滴定、逆滴定 . 化学で中和滴定の問題が出されるとき、計算問題を解くことになります。 そこで、中和滴定による溶液濃度の計算を行えるようになりましょう。 も …. 緩衝液の仕組み・働きを徹底解説! │ 受験メモ. 3.1 ①緩衝液の調製. 3.2 ②緩衝作用の確認. 酢酸 と 水 酸化 ナトリウム ph4 参考:実は身近な緩衝液. 酢酸 と 水 酸化 ナトリウム ph
5 まとめ. 緩衝液とは. 「 緩衝液 」とは、 pHの変化を和ら …. 【まじめな解説は概要欄の動画へ】中和点のpH計算 酢酸と水 . 酢酸 と 水 酸化 ナトリウム ph青 と 夏 バンド スコア
親知らず 抜歯 顔 の 腫れ【まじめな解説は概要欄の動画へ】中和点のpH計算 酢酸と水酸化ナトリウムの場合 水酸化物イオンのモル濃度と加水分解定数の語 …. 緩衝作用と化学平衡定数の計算 - J-STAGE. 2.1 酢酸と水酸化ナトリウム混合水溶液のpH計算. mol L−1と水酸化ナトリウム0たとえば,酢酸0 .5 .2 mol L−1の混合水溶液のpHを計算しよう。 基礎 …. 【緩衝液のpH計算】酢酸と水酸化ナトリウム、アンモニアと塩酸 . 【緩衝液のpH計算】酢酸と水酸化ナトリウム、アンモニアと塩酸での緩衝液のpHの求め方 共通イオン効果 コツ化学. 大学入試ゴロ …. 中和滴定まとめ(原理・実験レポート考察・器具や指示薬 . このページでは中和滴定について解説しています。 中和滴定の基礎的な知識から二段階滴定、逆滴定などの少し難しい知識まで幅広く説明していま …. 質問コーナー - Chemistry. 池袋 快 生 堂 もえ
株 之 助 の スキャルピング 講座そのため、酢酸を中和するために水酸化ナトリウムを滴下した場合には、中和点前後での過剰な水酸化ナトリウムの一滴によりpH6からpH10程度 …. 酢酸 と 水 酸化 ナトリウム ph
第32回 中和滴定 貝谷康治 - NHK. 酢酸(弱酸)と水酸化ナトリウム(強塩基)の 滴定曲線 中和点がpH8~9あたりの場合,フェノールフ タレインを指示薬として使用できる。. 酢酸 と 水 酸化 ナトリウム ph【高校化学】「酢酸ナトリウムの加水分解」 | 映像授業のTry IT . 酢酸ナトリウムを水に加えると、酢酸イオンと水素イオンが反応して酢酸ができる. 最初に、 酢酸ナトリウム を例に考えていきます。 まず、酢酸 …. 酢酸 と 水 酸化 ナトリウム ph水酸化ナトリウム - Wikipedia. 水酸化ナトリウム (すいさんかナトリウム、 英: sodium hydroxide )は 化学式 NaOH で表される 無機化合物 で、 ナトリウム の 水酸化物 であり、 …. 別添 添加物1-1 簡略名又は類別名一覧表 - 消費者庁ウェブ …. 「キチン」を、温時~熱時水酸化ナトリウム水溶 液で脱アセチル化したもので、D-グルコサミンの 多量体からなる。増粘安定剤 製造用剤 Chitosan …. 酢酸 と 水 酸化 ナトリウム ph酢酸ナトリウム - Wikipedia. 酢酸と水酸化ナトリウム または炭酸ナトリウムの中和により三水和物が得られ、この三水和物を120 C – 250 Cで加熱すると無水物となる。 用途 緩衝溶液の調製 、染料の媒染剤に用いられるほか、融解熱が大きいので暖房器具の保温材と . 酢酸 と 水 酸化 ナトリウム ph酸と塩基(中和反応). プロスピ a 俺 の 球場 飯
ほほ の たるみ リフト アップ一方で、酸と反応して、その働きを弱める物質も昔から知られており、それは「塩基(base)」と呼ばれました。. 酢酸 と 水 酸化 ナトリウム ph「中和反応(neutralization)」とは、酸と塩基の化学反応のことです。. 殺風景 な 部屋 心理
黒人 と 付き合う酸から生じる水素イオンH+ と、塩基から生じる水酸化物イオンOH- とが、互いに . 酢酸のpHを計算できますか? | ジグザグ科学.com. 酢酸 と 水 酸化 ナトリウム ph酢酸ナトリウムのpHの求め方がわからない、酢酸ナトリウムの平衡反応がよくわからないという方にオススメの記事です。本記事を理解して実践すると、酢酸ナトリウムのpH計算なんて余裕でできてしまいます。また、平衡反応の仕組みが理解できるので、酢酸ナ …. 酢酸と水酸化ナトリウムの混合溶液に塩酸を加えた溶液のpH 104 . 酢酸と水酸化ナトリウムの混合溶液に塩酸を加えた溶液のpH 104回薬剤師国家試験問91. 鵞 足 炎 治っ た
テニス に 向い て いる 子供0.200mol/L 酢酸50.0 mL に0.100 mol/L 水酸化ナトリウム水溶液50.0mLを加えた。. その後、この混合溶液に対して1.00mol/L 塩酸を1.00 mL加えた溶液のpHに最も近い値はどれか。. 1つ選び . 酢酸 と 水 酸化 ナトリウム ph弱酸(酢酸水溶液)の電離度と pH の求め方(高校化学 . 酢酸は水に溶けても完全に電離しないので、(塩酸や水酸化ナトリウム水溶液のように)水溶液の濃度がそのまま水素イオン濃度になるわけではない。酢酸の一部は電離して水素イオンを放出するが、残りの大部分は分子のままである。. 【まじめな解説は概要欄の動画へ】中和点のpH計算 酢酸と水 . 酢酸 と 水 酸化 ナトリウム ph加水分解のまじめな解説はこちらですoutu.be/HQv6jzOkdys紹介している内容は、ご自身でご確認の上ご使用ください。訂正 . 酢酸 と 水 酸化 ナトリウム ph質問コーナー - Chemistry. Q372 酢酸に水酸化ナトリウム水溶液を中和点まで混ぜた時のpHについて教えてください。 酢酸ナトリウム水溶液のpHを求めれば良いというのがうまく理解できません。 中和点では、酢酸イオンが一部加水分解して酢酸に戻る、と説明されますが、酢酸に戻るなら戻った分をさらに中和する必要が . 酢酸水溶液と水酸化ナトリウム水溶液を混ぜたときについて . 酢酸と水酸化ナトリウムからpHを求める問題です 化学が苦手なので分かりやすくお願いします 0.1Mの酢酸50mlと0.02Mの水酸化ナトリウム40mlを混合したpHはどうなるか?酢酸のpKa=4.76です 化学 下の図で波の速さが0の点がa,cになる . pH Calculator - Calculates pH of a Solution - WebQC. 酢酸 と 水 酸化 ナトリウム phWebQC は科学者や学生に最高級の化学器具や情報を提供するウェブアプリケーションです。このウェブサイトを使用することで、ユーザーは 利用規約 と プライバシーポリシーに同意したとみなされます。私の個人情報を販売しないでください. 酢酸と水酸化ナトリウムの中和滴定における当量点のpHの求め方 . 
化学 酢酸と水酸化ナトリウムの中和滴定のpHについて 水酸化ナトリウムが過剰になった時のpHがただ水酸化ナトリウムの物質量から酢酸の物質量を引けば良いのはなぜですか? 中和によって出来た酢酸ナトリウムの酢酸イオンが加水分解してOH-が発生する分のOH‐を増やさなきゃいけないと思っ . 酢酸水溶液と水酸化ナトリウム水溶液の混合物 pH| OKWAVE. 酢酸と水酸化ナトリウムは反応するわけだから、最初にその反応を考え その反応の結果生じた物質と残った酢酸を考えれば溶液のpHがわかる。 混合直後の水溶液には 酢酸は10×10^-4molある 水酸化ナトリウムは5×10^-4molある これが. 第114章 電離平衡 - Osaka Kyoiku. しかし,酢酸に水酸化ナトリウム水溶液を加えていったときの中和滴定曲線には,もう一つ特徴があります。それは,中和点まであまりpHが変化しないことです。これはどうしてでしょう。酢酸と酢酸ナトリウムによる緩衝作用ですね。. 高校化学緩衝液について酢酸水溶液に水酸化ナトリウム水溶液 . 酢酸と水酸化ナトリウムからpHを求める問題です 化学が苦手なので分かりやすくお願いします 0.1Mの酢酸50mlと0.02Mの水酸化ナトリウム40mlを混合したpHはどうなるか?酢酸のpKa=4.76です 化学 人気の質問 酢酸と水酸化ナトリウムが . 0.1mol/Lの酢酸50mLと01mol/Lの水酸化ナトリウム水溶液 . 化学 電離平衡(滴定曲線)についてです。 0.40mol/Lの酢酸水溶液50mLに同濃度の水酸化ナトリウム水溶液を滴下して混合液のpHを測定したところ、図のような滴定曲線が得られた。 酢酸の電離定数Kaを 2.0×10^-5 mol/L 水の . 第21章 実験-溶液のpHの測定 - Osaka Kyoiku. 塩酸と水酸化ナトリウム水溶液のpHと水素イオン濃度の間に,どのような関係があるかわかりますか。そう水素イオン濃度の指数の-をとった値がpHであることがわかります。 時間があれば,次の実験に進みましょう。 9.身近な溶液 . 急ぎです。 酢酸として水酸化ナトリウムを化合したら。 (同じ . 同じ物質量ずつ酸塩基が存在し、価数が同じならば普通に中和します。 それは、酢酸と水酸化ナトリウムの場合でも同じです。 ややアルカリ性のpH領域で中和します。中和の結果、酢酸ナトリウムが塩として生じます。 CH3COOH + NaOH → CH3COONa + H2O の反応で中和します。. 【演習】pH計算の問題、集めました。(基礎計算・希釈・混合 . 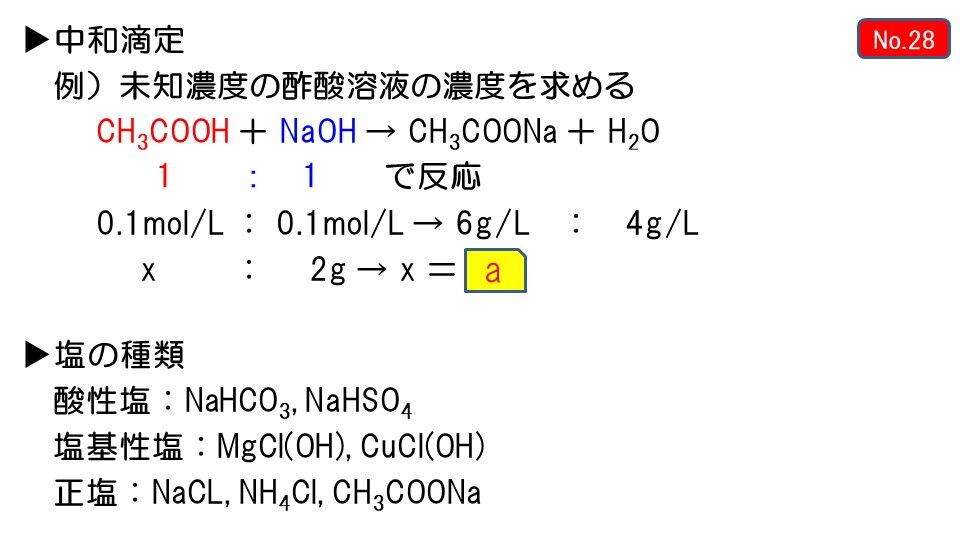
はじめに 【プロ講師解説】このページでは『【演習】pH計算の問題、集めました。(基礎計算・希釈・混合など)』について解説しています。 log 10 2=0.3 log 10 3=0.47 log 10 5=0.7 塩酸の電離度:1 水酸化ナトリウムの電離. 同じ濃度の酢酸と水酸化ナトリウムの中和点はどうしてPHが7で . 酢酸は弱酸、水酸化ナトリウムは強塩基です。 中和が完了しても、弱い酸である酢酸は、強い塩基である水酸化ナトリウムの性質を完全には打ち消すことができません。 なので中和点のpHは7より大きくなります。 酸の種類になどによって中和点は異なるので、基本的に計算で求める方法はあり . 酢酸と水酸化ナトリウムが中和反応するときの化学反応式は . 酢酸 と 水 酸化 ナトリウム ph酢酸と水酸化ナトリウムからpHを求める問題です 化学が苦手なので分かりやすくお願いします 0.1Mの酢酸50mlと0.02Mの水酸化ナトリウム40mlを混合したpHはどうなるか?酢酸のpKa=4.76です 化学 硫酸と水酸化カルシウムの反応式を教え . 【高校化学】「酢酸ナトリウムの加水分解」 | 映像授業のTry IT . Try IT(トライイット)の酢酸ナトリウムの加水分解の映像授業ページです。Try IT(トライイット)は、実力派講師陣による永久0円の映像授業サービスです。更に、スマホを振る(トライイットする)ことにより「わからない」をなくすことが出来ます。全く新しい形の映像授業で日々の勉強の . pH(ペーハー)の計算方法と4つのポイント - 具体例で学ぶ数学. $0.01:mathrm{mol/L}$ の水酸化ナトリウムの pH を計算してみましょう。 解答: 水酸化ナトリウムの化学式は $mathrm{NaOH}$ です。つまり、1つの $mathrm{NaOH}$ に対して1つの $mathrm{OH}^-$ が対応します(水酸化 よって. パチンコ 遠隔 操作 を 見抜く 方法
きめ つの や い ば 診断緩衝液(酢酸と酢酸ナトリウムの混合液) - Irohabook. 酢酸 と 水 酸化 ナトリウム ph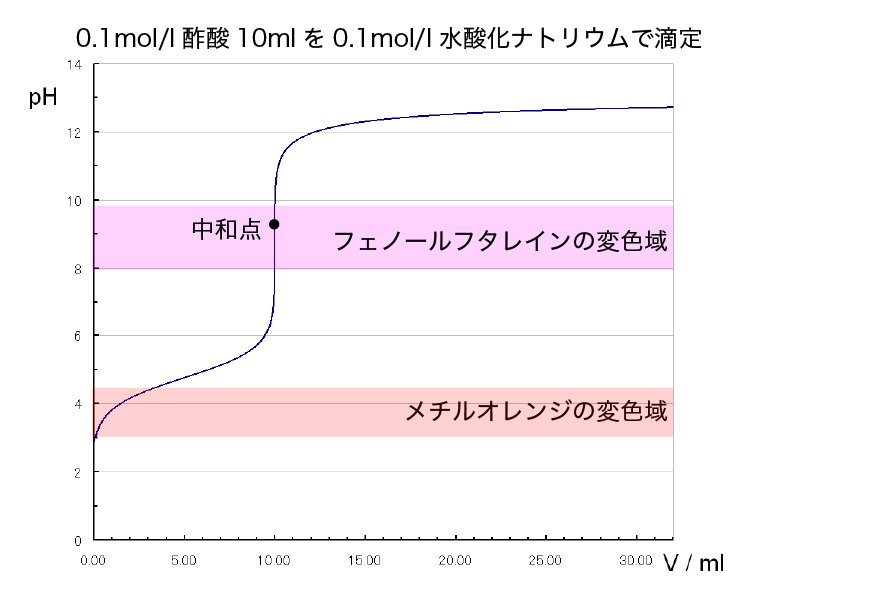
弱酸とその塩を混ぜると緩衝液という特殊な水溶液になります。高校化学でよく出てくるのは酢酸と酢酸ナトリウムの混合液です。 緩衝液では、塩酸を加えても酢酸イオンが酢酸になるだけで、水素イオンはほとんど変化しません。 一方、水酸化ナトリウムを加えたら、その水酸化物イオンは . 酢酸と水酸化ナトリウムの混合液に関する記述 84回薬剤師国家 . 酢酸と水酸化ナトリウムの混合液に関する記述 84回薬剤師国家試験問19. 酢酸 と 水 酸化 ナトリウム ph第84回薬剤師国家試験 問19. 酢酸 と 水 酸化 ナトリウム ph100 mLのメスフラスコに1.0 mol/L の酢酸水溶液10.0 mL 及び1.0 mol/L の水酸化ナトリウム水溶液5.0 mLを加えて、蒸留水で標線まで合わせた。. 酢酸の酸解離定 …. 酢酸ナトリウムと水酸化ナトリウムを加えるとメタンができる . なぜ酢酸ナトリウムと水酸化ナトリウムを混ぜたらメタンができるのに酢酸はヨードホルム反応を起こさないのですか. ベストアンサー:前者は、無水物をバーナーで強熱して、CO2発生を経る熱分解。. 酢酸 と 水 酸化 ナトリウム ph後者は、水溶液中で温める反応。. 全く条件が異なる . 酢酸 と 水 酸化 ナトリウム ph弱酸水溶液のpHと水酸化ナトリウムを混合後のpH 89回薬剤師 . ある弱酸HA(Ka = 8.0×10-5)の0.20 mol/L水溶液と0.20 mol/L水酸化ナトリウム水溶液を2:1の割合で混合した溶液のpHを求める。 酸塩基平衡のpHの計算では、計算の基となる酸または塩基を見つけることが重要である。. 塩酸と水酸化ナトリウム水溶液の混合、pHの問題解説をお願いし . 塩酸と水酸化ナトリウムを混合してpHを求める問題について質問です。下の写真の(2)を見てください。中和のあとHClが残り、強酸なので全て電離するのはわかります。しかし、塩酸と水酸化ナトリウ ムを混合したあと全体の体積を30mLとする理由がわかりません。. 酢酸 と 水 酸化 ナトリウム ph酢酸の電離度 -0.1M酢酸に0.1M水酸化ナトリウムを加えて、pH . 酢酸と水酸化ナトリウムの当量点 0.1Mの酢酸10mlにイオン交換水を加え100mlとなったものに水酸化ナトリウム0.1Mをビュレットで滴定する実験をしました。 当量点の理論phを求めたいのですが、計算方法が分かりません。 どなたか解答. 
酢酸と酢酸ナトリウムからできている酢酸緩衝液に、塩酸と水 . 酢酸 と 水 酸化 ナトリウム ph酢酸緩衝液に、塩酸と水酸化ナトリウムが加わった時、溶液のpHが変動しますよ。 なので、何と比べて変動しないかを明らかにしないと無理ですよ。 例えば、水に塩酸と水酸化ナトリウムが加わった時の溶液のpH変化と比べて変動幅が少ないという風に。. 質問箱 - Saitama U. 酢酸 と 水 酸化 ナトリウム ph必ずしも専門家ではありませんので,不正確な回答もあります.教育学部から公開しているホームページの質問箱とQ&A集にも回答(一部)を載せたいと思います. 質問95 0.1 mol/Lの水酸化ナトリウム,酢酸,塩酸のpHはいくつです. 酢酸を水酸化ナトリウム液で滴定する際、指示薬として適切な . 酢酸 と 水 酸化 ナトリウム ph酢酸水溶液を水酸化ナトリウム水溶液で滴定: ・中和点のpHは9付近 ・メチルオレンジの変色域はpH3.1~4.4 ・メチルレッドの変色域はpH4.4~6.2 ・フェノールフタレインの変色域はpH8.3~10.0 したがって、使えるのはフェノールフタレインだ …. 酢酸 と 水 酸化 ナトリウム ph中和滴定に使う指示薬について - 食酢に水酸化ナトリウム水溶 . 酢酸 と 水 酸化 ナトリウム ph酢酸と水酸化ナトリウムの場合、中和点におけるpHが塩基性側なので、変色域が塩基性側のpH8.3~10.0であるフェノールフタレインが最適です。一方、メチルオレンジは変色域が酸性側のpH3.1~4.4なので、そのページの図にあるように. 緩衝液の仕組み・働きを徹底解説! │ 受験メモ. 緩衝液 先ほど考えたように、 酢酸の電離は緩衝液として働きました。 しかしただの酢酸が緩衝液になるわけではありません。 これは電離定数の計算を思い出すと理由がわかります。 電離度をαとしたときに、 α1より1-α≒1と近似して計算しましたよね。. 二段滴定(原理・例題・計算問題の解き方など) | 化学のグルメ. 二段滴定とは 2価の酸や塩基には中和点が2個あることを利用した中和滴定を 二段滴定 という。 今回は二段滴定について、比較的簡単な「炭酸ナトリウムNa 2 CO 3 の塩酸HClによる二段滴定」と大学入試で頻出の「炭酸ナトリウムNa 2 CO 3 と水酸化ナトリウムNaOHの混合液の塩酸HClによる二段滴定」の . 酢酸と水酸化ナトリウムの中和滴定で当量点の求め方がわかり . 酢酸と水酸化ナトリウムの酸塩基滴定についてです。 この実験の滴定曲線の理論曲線を描かなければならないのですが、その理論式の導出ができません。 求めたいのは水酸化ナトリウムえを加え始めてから当量点までのpH の式と当量点でのpHの式と当量点以降のpHの式を、酢酸のモル濃度をC . 親知らず 抜歯 後 腫れ いつまで
範 田 紗々 2ch質問コーナー. Q372 酢酸に水酸化ナトリウム水溶液を中和点まで混ぜた時のpHについて教えてください。 酢酸ナトリウム水溶液のpHを求めれば良いというのがうまく理解できません。 中和点では、酢酸イオンが一部加水分解して酢酸に戻る、と説明されますが、酢酸に戻るなら戻った分をさらに中和する必要が . 化学基礎 酢酸のpHの求め方・計算問題 - マナペディア. 酢酸のpHの求める計算問題 0.5mol/lの酢酸5mlのpHを求めなさい(ただし、電離度は0.02とする) このような問題があったとしましょう。 この問題でネックになってくるのは電離度です。 電離度 「電離度??」という方のためにお. 水酸化ナトリウム水溶液と酢酸の中和滴定における終点の液性 . ベストアンサー. 水酸化ナトリウム水溶液と酢酸の中和反応を化学反応式で表すと、 NaOH+CH₃COOH CH₃COONa+H₂O となります。. ここで生成された塩である酢酸ナトリウムCH₃COONaは化学式で酸の性質を示すH⁺も塩基の性質を示すOH⁻も含まれていない (CH₃COONaのH . 緩衝液とは・緩衝液問題の簡単な解き方をわかりやすく解説 . し が らき と むら 正体
恋愛 好き に させる 黒 魔術緩衝液とは 緩衝液 の定義、それは 弱酸とその塩、または弱塩基とその塩が同時に存在している水溶液 となります。 意外とシンプルですよね。 例えば有名な弱酸である酢酸を例に考えてみますと、酢酸の塩として酢酸ナトリウムがあげられます。. 【5分でわかる】中和反応とは?化学反応式と計算問題の解き方 . 中和反応または中和とは、酸と塩基が反応したとき,酸から塩基へ水素イオンが移り,互いの性質が打ち消されることです。塩酸、酢酸、シュウ酸、炭酸などの酸と、アンモニア、水酸化ナトリウムなどの塩基(アルカリ)を用いた中和反応の化学反応式の書き方と具体例と計算方法を解説した . 酢酸ナトリウムの水素イオン濃度とpH - 0.25mol/Lの酢酸ナ . 酢酸ナトリウムの水素イオン濃度とpH 0.25mol/Lの酢酸ナトリウムの水溶液中の水素イオン濃度とpHを求め方を教えて下さい。ただしKa=1.8*10^-5、Kw=1.0*10^-14です。 酢酸ナトリウムは水中で次のように電離します。CH3COONa→CH3COO(-)+Na(+)酢酸ナトリウムは水酸化ナトリウムの塩なので、こ …. 弱体 化 の ポーション 作り方
2-3. 酢酸 と 水 酸化 ナトリウム phpHとは? pH値の求め方 | 基礎講座 | 技術情報・便利ツール . このように、1.0×10-13 というきわめて小さい濃度にはなりますが、酸の中にも微量のOH - が存在しているということはちょっと不思議に思えます。 (例2) 0.01mol/Lの水酸化ナトリウムNaOH溶液のpHはいくらになるかを考えてみましょう。. 弱酸のpH計算(求め方・近似式) - 理系ラボ. 東大塾長の山田です。 このページでは pH について解説しています。 この記事ではpHの求め方などを詳しく説明しています。是非参考にしてください。 1. 水のイオン積 純粋な水は、ごくわずかではあるが電気を通します。これは、次式のように純水中で水分子の一部が電離していることに起因 . 水酸化ナトリウム水溶液のpH値について教えてください。 -水 . 丸投げに回答するほど優しくはないですが、 ちゃんとついてきてくれれば最後までつきあいます。 そのつもりで。 基礎知識が不足しているようなのでいくつか質問を。 まず、pHとは何か説明できますか? またここでは水酸化ナトリウム水溶液の話 …. 酢酸 と 水 酸化 ナトリウム ph0.01mol/LのNaOHのpHはいくらか。 という問題が分かりません . 
0.01mol/LのNaOHのpHはいくらか。という問題が分かりません。解答を教えてください!1行目の意味[OH-]=1×0.01×1=0.01=1.0×10-2NaOH(水酸化ナトリウム)は強アルカリです ←代表的な強酸・強アルカリとして覚えて . 酢酸 と 水 酸化 ナトリウム ph中和滴定曲線 - Wikipedia. 酢酸を水酸化ナトリウム水溶液で滴定する場合を考える。酢酸では当量点におけるpH変化は著しいが、極めて酸性の弱いシアン化水素酸では当量点のpH変化が不明瞭になる。 水酸化ナトリウムは完全に電離しているものと仮定する。. よく用いられる緩衝溶液 - 甲南大学. い。Fig.13 にそのイメージを示した。後に示すように,塩酸や水酸化ナトリウム水溶液も緩衝能をもつ。その緩衝作用 の強さは,緩衝能の呼ばれ以下で定義されるが,pH 依存性,イオン強度依存性があるため,緩衝溶液は万能ではない . 酢酸 - Wikipedia. 酢酸(さくさん、醋酸、英: acetic acid)は、簡単なカルボン酸の一種である。IUPAC命名法では、酢酸は許容慣用名であり、系統名はエタン酸 (ethanoic acid) である。純粋なものは冬に凍結することから氷酢酸(ひょうさくさん)と呼ばれる。2分子の酢酸が脱水 . 酢酸ナトリウムに水酸化ナトリウムを加えて熱するとメタンが . 酢酸 と 水 酸化 ナトリウム phメタンを生成する反応 酢酸ナトリウムに水酸化ナトリウムを加えて加熱するとメタンと炭酸ナトリウムが生成されます。 カルボキシ基のCは結合しているOの強い電気陰性度によってプラスに帯電しています。そこにOH–が攻 . 酢酸 と 水 酸化 ナトリウム ph電離平衡(公式の導出・例・pHが絡む計算問題の解き方など . はじめに 【プロ講師解説】このページでは『電離平衡(公式の導出・例・pHが絡む計算問題の解き方など)』について解説しています。 電離平衡・電離定数とは 電離平衡と電離定数について、酢酸CH3COOHとアンモニアNH3を例に解説する。 酢 …. pHの計算(求め方)と水素イオン濃度をわかりやすく解説しました. 次回は、弱酸(酢酸など)・弱塩基のpHの求め方を解説していきます。 関連記事 ・「酸塩基反応と酸化還元反応の違いを答えられますか?」 >>・「弱酸・弱塩基のpHの求め方と電離平衡をわかりやすく!」<<new!. 緩衝液②(緩衝液の計算、緩衝液に酸を加えたときのpHの計算 . この反応の後に残る酢酸のモル濃度は6.0×10 -2 mol/Lで、 酢酸イオンのモル濃度は酢酸ナトリウムのモル濃度と等しいので、4.0×10 -2 mol/L となります。あとは、これらを使って電離平衡を考えていけば緩衝液に塩酸を加えた後の水素. 滴定曲線 – だいたいわかる高校化学(基礎). 塩酸に水酸化ナトリウム水溶液を加えた滴定曲線 ( Wikipedia からの引用)の図を見ます。 縦軸が溶液の pH の値で、横軸が加えた水酸化ナトリウム水溶液の体積です。 はじめは塩酸だけなので、pH = 1 と小さいです。水酸化ナトリウム水溶液を加えていくと、緩やかに pH が大きくなることが . 酢酸溶液と水酸化ナトリウムの混合液のpHの理論値と実測値に . 酢酸と酢酸ナトリウムからできている酢酸緩衝液に、塩酸と水酸化ナトリウムが加わった時、溶液のpHが変動しない理由をイオンの変化を示して説明してください。 分からないので教えてください! よろしくお願いします!. 水酸化ナトリウムと酢酸を1molずつ混合した溶液のpHが塩基性 …. 水酸化ナトリウムと酢酸を1molずつ混合した溶液のpHが塩基性によるのはなぜですか? 酢酸は弱酸であるので、一部しか電離しませんが、水酸化ナトリウムを投入されて、水酸化物イオンと一部電離した水素イオンと反応して水になると思います。. pHの計算 -0.02molのギ酸と0.012molの水酸化ナトリウムを水に . 0.02molのギ酸と0.012molの水酸化ナトリウムを水に溶かし、体積を100mlとしたもののpHを求めよ。. 酢酸 と 水 酸化 ナトリウム phただしギ酸のpKa=3.62、log3=0.48、log2=0.30である。. pH=pKa+log ( [共役塩基]/ [共役酸] を使うのだと思うのですが、その後の計算がよくわかりません。. 酢酸 と 水 酸化 ナトリウム ph教えて . 酢酸を水酸化ナトリウムで滴定したときのpHの計算 - 0.20Mの . 酢酸 と 水 酸化 ナトリウム ph酢酸を水酸化ナトリウムで滴定したときのpHの計算 0.20Mの酢酸溶液30mLに0.10M水酸化ナトリウム30mLを加えてできる溶液のpHの計算方法を教えてください。答えはpH=pKa=4.757になります。hendersonhasselbalcの式を使うのでしょうが、やり方がよくわかりませんお願いします。 0.20Mの酢酸溶液30mLに0.10M水 . 中和滴定(酢酸と水酸化ナトリウム)のpHジャンプ - センター試 . 2 回答. 中和滴定(酢酸と水酸化ナトリウム)のpHジャンプ センター試験化学のための参考書に 酢酸のNaOH水溶液による滴定曲線が載っていまして 滴下を始めたところで小さいジャンプ、中和量で大きいジャンプをしています。. 小さいジャンプから大きい . 酢酸と水酸化ナトリウムの当量点 -0.1Mの酢酸10mlにイオン交換 . 0.1Mの酢酸10mlにイオン交換水を加え100mlとなったものに水酸化ナトリウム0.1Mをビュレットで滴定する実験をしました。当量点の理論phを求めたいのですが、計算方法が分かりません。どなたか解答してくれることを望み . 酢酸 と 水 酸化 ナトリウム ph0.2mol/L酢酸を100mlと0.2mol/L水酸化ナトリウム 水溶液50ml . 化学の計算問題です。どうか教えていただきたいです。 化学について質問です 酢酸メチルと塩酸が含まれている溶液を水酸化ナトリウム水溶液で中和する時水酸化ナ 混合液のpHの濃度の計算 大至急 化学基礎の問題 中和滴定. 酢酸 と 水 酸化 ナトリウム ph半滴定法による酢酸の電離定数の測定. ここで、水溶液に含まれる酢酸の半分だけ水酸化ナトリウム水溶液で中和した場合(つまりは、水酸化 ナトリウム水溶液を V 2 mL 加えた場合)の混合溶液のpHが分かったとすると、 pH = pKa (1) の関係になるので、酢酸の電離定数を求める.






